公司: 杨森制药公司
批准日期: 2022 年 2 月 28 日
治疗:多发性骨髓瘤
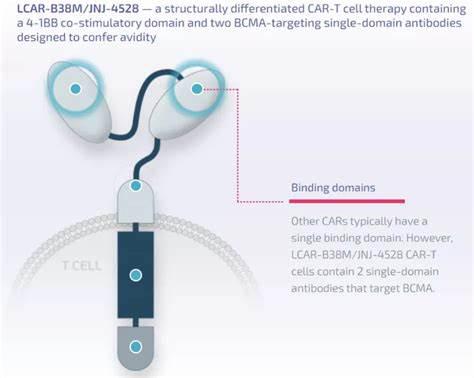
Carvykti(ciltacabtagene autoleucel)是一种针对 BCMA 的 CAR-T 免疫疗法,用于治疗复发或难治性多发性骨髓瘤患者。
美国食品药品监督管理局 (FDA) 已批准 Carvykti (ciltacabtagene autoleucel; cilta-cel) 用于治疗成人复发或难治性多发性硬化症骨髓瘤 (RRMM) 在四个或更多先前的治疗线后,包括蛋白酶体抑制剂、免疫调节剂和抗
CD38 单克隆抗体。1该批准基于关键性 CARTITUDE-1 研究的数据,其中包括接受过中位数 6 次先前治疗方案(范围 3-18)并且之前接受过蛋白酶体抑制剂、免疫调节剂和抗-
CD38 单克隆抗体。12017 年 12 月,杨森与 Legend Biotech USA, Inc. 签订了一项全球独家许可和合作协议,以开发和商业化 ciltacabtagene autoleucel。
Carvykti 是一种嵌合抗原受体 T 细胞 (CAR-T) 疗法,具有两种靶向 B 细胞成熟抗原 (BCMA) 的单域抗体。1在关键的 CARTITUDE-1 研究中,使用 ciltacabtagene autoleucel 的一次性治疗产生了深度和持久的反应,98%(95% 置信区间 [CI],92.7-99.7)的 RRMM 患者对治疗有反应(总体上 98%反应率 [ORR] (n=97) 。值得注意的是,78% (95% CI, 68.8-86.1) 达到此反应水平的患者 (n=76) 经历了严格的完全反应 (sCR),这是在医生在治疗后无法通过影像学或其他测试观察到疾病的任何体征或症状。在中位 18 个月的随访中,中位缓解持续时间 (DOR) 为 21.8 个月。
Carvykti 只能通过称为 Carvykti REMS 计划的风险评估和缓解策略 (REMS) 下的受限计划获得。 Carvykti 的安全信息包括关于细胞因子释放综合征 (CRS)、免疫效应细胞相关神经毒性综合征 (ICANS)、帕金森综合征和格林巴利综合征、噬血细胞性淋巴组织细胞增多症/巨噬细胞活化综合征 (HLH/MAS) 和长期和/或复发性血细胞减少症。1警告和注意事项包括长期和复发性血细胞减少、感染、低丙种球蛋白血症、超敏反应、继发性恶性
肿瘤以及对驾驶和使用机器能力的影响。1最常见的不良反应(≥20%)是发热、CRS、低丙种球蛋白血症、低血压、肌肉骨骼疼痛、疲劳、感染病原体不明、咳嗽、寒战、腹泻、恶心、脑病、食欲下降、上呼吸道感染、头痛、心动过速、头晕、呼吸困难、水肿、病毒感染、凝血障碍、便秘和呕吐。
“我们致力于利用我们的科学、对疾病的深刻理解和能力来推进像 Carvykti 这样的细胞疗法,因为我们将继续专注于为多发性骨髓瘤提供治疗的最终目标,”医学博士 Peter Lebowitz 表示, Janssen Research & Development, LLC
肿瘤学全球治疗领域负责人。“我们衷心感谢参与 Carvykti 临床研究并获得今天批准的患者、他们的家人以及研究人员和研究中心团队。”
多发性骨髓瘤是一种无法治愈的血癌,它会影响一种称为浆细胞的白细胞,这种白细胞存在于骨髓中。尽管近年来开发了其他治疗方案,但大多数多发性骨髓瘤患者在接受三种主要治疗类别(包括免疫调节剂、蛋白酶体抑制剂和抗 CD38 单克隆抗体)治疗后疾病进展后面临预后不良。
“CARTITUDE-1 研究中的反应随着时间的推移显示出持久性,并导致大多数接受过大量预处理的患者在 18 个月的随访后获得深度反应,”多发性骨髓瘤卓越中心主任Sundar Jagannath 医学博士†说西奈山伊坎医学院 Tisch 癌症研究所医学、血液学和医学肿瘤学教授,以及首席研究人员。“cilta-cel 的批准为医生提供了一种免疫疗法治疗选择,让患者有机会在一段时间内免于抗骨髓瘤治疗。”
作为一种个性化药物,Carvykti 治疗需要广泛的培训、准备和认证,以确保为患者带来积极的体验。通过分阶段的方法,杨森和传奇生物技术将启动有限的认证治疗中心网络,因为该公司致力于在 2022 年及以后扩大其生产能力并增加 Carvykti 在美国的可用性,以确保我们能够为以下人群提供 Carvykti 治疗以可靠和及时的方式为肿瘤科医生及其患者提供服务。
“杨森的首个细胞疗法获得批准证明了我们在肿瘤学领域的持续承诺,即提供新的治疗选择并推动我们实现消除癌症的愿景,”制药执行副总裁 Mathai Mammen 医学博士说, Janssen Research & Development, LLC, 强生公司。“今天的批准强调了我们开发疗法的决心,这些疗法可以帮助患有今天仍然是顽固性血癌的患者,同时为未来带来希望。”
正在进行的 CARTITUDE-1 研究正在评估 ciltacabtagene autoleucel 的长期疗效和安全性。最近在美国血液学会 (ASH) 2021 年会上公布的两年随访结果显示,接受 ciltacabtagene autoleucel 治疗 RRMM 的患者中有 98% 对治疗有反应(98% 的总体反应率 [ORR] (n=97) ,并且大多数患者实现了持续深度反应,83% 的患者在 22 个月的随访中实现了sCR。
关于 Carvykti (ciltacabtagene autoleucel)
Carvykti 是一种针对 BCMA 的转基因自体 T 细胞免疫疗法,它涉及用编码嵌合抗原受体 (CAR) 的转基因重新编程患者自身的 T 细胞,该受体可识别并消除表达 B -细胞成熟抗原(BCMA)。BCMA 主要在恶性多发性骨髓瘤 B 系细胞以及晚期 B 细胞和浆细胞表面表达。Carvykti CAR 蛋白具有两种靶向 BCMA 的单域抗体,旨在赋予对人类 BCMA 的高亲和力。在与表达 BCMA 的细胞结合后,CAR 会促进 T 细胞的活化、扩增和靶细胞的消除。
2017年12月,Janssen Biotech, Inc.与Legend Biotech USA, Inc.签订了一项全球独家许可和合作协议,以开发和商业化ciltacabtagene autoleucel。
2021年4月,杨森宣布向欧洲药品管理局提交上市许可申请,寻求批准 Carvykti 用于治疗复发和/或难治性多发性骨髓瘤患者。除了 2019 年 12 月授予的美国突破性治疗指定外,西他卡他基因 autoleucel 还于 2020 年 8 月在中国获得了突破性治疗指定。杨森还于 2019 年 2 月获得美国 FDA 和 2 月欧盟委员会授予的 Carvykti 孤儿药指定2020 年。
关于 CARTITUDE-1 研究
CARTITUDE-1 (NCT03548207) 是一项正在进行的 1b/2 期、开放标签、多中心研究,评估 ciltacabtagene autoleucel 用于治疗先前接受过蛋白酶体抑制剂的复发或难治性多发性骨髓瘤患者。 PI)、一种免疫调节剂 (IMiD) 和一种抗 CD38 单克隆抗体,并且在最后一次治疗期间或之后出现疾病进展。研究中的所有患者都接受了中位数的六种先前治疗方案(范围,3-18)。在参加试验的 97 名患者中,99% 对最后一线治疗无效,88% 为三类难治,这意味着他们的癌症对 IMiD、PI 和抗CD38 单克隆抗体。
关于多发性骨髓瘤
多发性骨髓瘤是一种无法治愈的血癌,它会影响一些称为浆细胞的白细胞,这些白细胞存在于骨髓中。3当受损时,这些浆细胞会迅速扩散并用肿瘤取代骨髓中的正常细胞。到 2022 年,估计美国将有超过 34,000 人被诊断出患有多发性骨髓瘤,超过 12,000 人将死于该病5虽然一些被诊断患有多发性骨髓瘤的人最初没有任何症状,但大多数患者被诊断出是由于症状可能包括骨折或疼痛、红细胞计数低、疲倦、高钙水平、肾脏问题或感染。
Carvykti 重要安全信息
适应症和用途
Carvykti (ciltacabtagene autoleucel) 是一种 B 细胞成熟抗原 (BCMA) 导向的转基因自体 T 细胞免疫疗法,适用于治疗成人复发性或难治性多发性骨髓瘤患者,经过四个或多个先前的治疗线,包括蛋白酶体抑制剂、免疫调节剂和抗 CD38 单克隆抗体。
警告:细胞因子释放综合征、神经系统毒性、HLH/MAS 以及长期和复发性细胞减少症
使用 Carvykti 治疗的患者发生细胞因子释放综合征 (CRS),包括致命或危及生命的反应。不要给患有活动性感染或炎症性疾病的患者服用 Carvykti。用托珠单抗或托珠单抗和皮质类固醇治疗严重或危及生命的 CRS。
免疫效应细胞相关神经毒性综合征 (ICANS) 可能是致命或危及生命的,在使用 Carvykti 治疗后发生,包括在 CRS 发作之前、与 CRS 同时、在 CRS 消退之后或在没有 CRS 的情况下。用 Carvykti 治疗后监测神经系统事件。根据需要提供支持性护理和/或皮质类固醇。
帕金森氏症和格林-巴利综合征及其相关并发症导致致命或危及生命的反应在使用 Carvykti 治疗后发生。
Carvykti 治疗后的患者发生噬血细胞性淋巴组织细胞增多症/巨噬细胞激活综合征 (HLH/MAS),包括致命和危及生命的反应。HLH/MAS 可伴有 CRS 或神经毒性。
Carvykti 治疗后出现长期和/或复发性血细胞减少,伴有出血和感染,需要干细胞移植以恢复造血功能。
Carvykti 只能通过称为 Carvykti REMS 计划的风险评估和缓解策略 (REMS) 下的受限计划获得。
警告和注意事项
细胞因子释放综合征 (CRS)95% (92/97) 接受 ciltacabtagene autoleucel 的患者在接受 Carvykti 治疗后发生包括致命或危及生命的反应。5% (5/97) 的患者发生 3 级或更高 CRS(2019 ASTCT 等级),1 名患者报告了 5 级 CRS。CRS 发病的中位时间为 7 天(范围:1-12 天)。CRS 最常见的表现包括发热 (100%)、低血压 (43%)、天冬氨酸氨基转移酶 (AST) 升高 (22%)、寒战 (15%)、丙氨酸氨基转移酶升高 (14%) 和窦性心动过速 (11%) . 与 CRS 相关的 3 级或更高级别事件包括 AST 和 ALT 升高、高胆红素血症、低血压、发热、缺氧、呼吸衰竭、急性肾损伤、弥散性血管内凝血、HLH/MAS、心绞痛、室上性和室性心动过速、不适、肌痛、
根据临床表现识别 CRS。评估和治疗发热、缺氧和低血压的其他原因。据报道,CRS 与 HLH/MAS 的发现有关,并且这些综合征的生理学可能重叠。HLH/MAS 是一种可能危及生命的疾病。在治疗后仍有 CRS 或难治性 CRS 症状的患者,评估 HLH/MAS 的证据。
97 名 (71%) 患者中的 69 名 (71%) 在输注 ciltacabtagene autoleucel 后接受了托珠单抗和/或皮质类固醇治疗 CRS。44 名 (45%) 患者仅接受托珠单抗治疗,其中 33 名 (34%) 接受单剂治疗,11 人 (11%) 接受多剂治疗;24 名患者 (25%) 接受了托珠单抗和皮质类固醇,1 名患者 (1%) 仅接受了皮质类固醇。确保在输注 Carvykti 之前至少有两剂托珠单抗可用。
在经 REMS 认证的医疗机构输注 Carvykti 后,至少每天监测患者 10 天,以了解 CRS 的体征和症状。输注后至少 4 周监测患者的 CRS 体征或症状。在出现 CRS 的第一个迹象时,立即开始使用支持性护理、托珠单抗或托珠单抗和皮质类固醇进行治疗。
如果任何时候出现 CRS 的体征或症状,建议患者立即就医。
用 Carvykti 治疗后发生的神经系统毒性可能是严重的、危及生命的或致命的。神经毒性包括 ICANS、伴有帕金森症状和体征的神经毒性、格林-巴利综合征、周围神经病变和颅神经麻痹。就这些神经毒性的体征和症状,以及其中一些毒性的延迟发作向患者提供咨询。如果任何这些神经毒性的体征或症状在任何时候出现,指导患者立即就医以进行进一步评估和管理。
总体而言,26% (25/97) 的患者在使用 ciltacabtagene autoleucel 后出现下述一种或多种神经毒性亚型,其中 11% (11/97) 的患者经历了 3 级或更高级别的事件。在两项正在进行的研究中也观察到了这些神经毒性亚型。
免疫效应细胞相关神经毒性综合征 (ICANS):23% (22/97) 接受 ciltacabtagene autoleucel 的患者发生 ICANS,包括 3% (3/97) 的 3 级或 4 级事件和 2% 的 5 级(致命)事件(2/97)。ICNS 发病的中位时间为 8 天(范围 1-28 天)。所有 22 名 ICNS 患者均患有 CRS。ICNS 最常见(≥5%)的表现包括脑病(23%)、失语(8%)和头痛(6%)。
在经 REMS 认证的医疗机构输注 Carvykti 后,至少每天监测患者 10 天,以了解 ICANS 的体征和症状。排除 ICNS 症状的其他原因。输注后至少 4 周监测患者的 ICNS 体征或症状并及时治疗。神经毒性应根据需要通过支持治疗和/或皮质类固醇进行管理。
帕金森症:在 CARTITUDE-1 研究的 25 名患者中,有 5 名男性患者出现神经系统毒性,并伴有多种帕金森症的体征和症状,与免疫效应细胞相关神经毒性综合征 (ICANS) 不同。其他正在进行的 ciltacabtagene autoleucel 试验报告了帕金森症的神经系统毒性。患者有帕金森和非帕金森症状,包括震颤、运动迟缓、不自主运动、刻板印象、自发运动丧失、蒙面脸、冷漠、平淡的情感、疲劳、僵硬、精神运动迟缓、显微书写、书写困难、失用、嗜睡、意识模糊、嗜睡, 意识丧失, 反射延迟, 反射亢进, 记忆力减退, 吞咽困难, 大便失禁, 跌倒, 弯腰姿势, 蹒跚步态, 肌肉无力和消瘦, 运动功能障碍、运动和感觉丧失、运动性缄默症和额叶释放体征。CARTITUDE-1 中 5 名患者的帕金森综合征发病中位数为 ciltacabtagene autoleucel 输注后 43 天(范围 15-108 天)。
监测患者的帕金森病体征和症状,这些体征和症状可能会延迟发作并通过支持性护理措施进行管理。用于治疗帕金森病的药物的疗效信息有限,用于改善或缓解 Carvykti 治疗后的帕金森症状。
格林-巴利综合征:尽管接受了静脉内免疫球蛋白治疗,但在另一项正在进行的 ciltacabtagene autoleucel 研究中发生了格林-巴利综合征 (GBS) 后的致命结果。报告的症状包括与 GBS 的 Miller-Fisher 变体一致的症状、脑病、运动无力、言语障碍和多发性神经根神经炎。
监测 GBS。评估出现周围神经病变的 GBS 患者。根据 GBS 的严重程度,考虑采用支持性护理措施并结合免疫球蛋白和血浆置换治疗 GBS。
周围神经病变:CARTITUDE-1 中有 6 名患者出现周围神经病变。这些神经病表现为感觉、运动或感觉运动神经病。症状发作的中位时间为 62 天(范围 4-136 天),周围神经病变的中位持续时间为 256 天(范围 2-465 天),包括那些持续存在神经病变的患者。在其他正在进行的 ciltacabtagene autoleucel 试验中,患有周围神经病变的患者也会出现颅神经麻痹或 GBS。
颅神经麻痹:三名患者 (3.1%) 在 CARTITUDE-1 中经历了颅神经麻痹。三名患者均为第 7 颅神经麻痹;一名患者也有第五颅神经麻痹。中位发病时间为 ciltacabtagene autoleucel 输注后 26 天(范围 21-101 天)。正在进行的ciltacabtagene autoleucel试验也报道了第3和第6脑神经麻痹的发生,双侧第7脑神经麻痹,改善后脑神经麻痹恶化,以及颅神经麻痹患者发生周围神经病变。监测患者颅神经麻痹的体征和症状。根据体征和症状的严重程度和进展,考虑使用全身性皮质类固醇进行管理。
噬血细胞性淋巴组织细胞增多症 (HLH)/巨噬细胞激活综合征 (MAS:在 ciltacabtagene autoleucel 后 99 天,一名患者 (1%) 发生了致命的 HLH。HLH 事件之前是持续 97 天的延长 CRS。HLH/MAS 的表现包括低血压、缺氧伴弥漫性肺泡损伤、凝血功能障碍、血细胞减少和多器官功能障碍,包括肾功能障碍。HLH 是一种危及生命的疾病,如果不及早发现和治疗,死亡率很高。HLH/MAS 的治疗应按照机构标准进行.
Carvykti REMS:由于存在 CRS 和神经毒性的风险,Carvykti 只能通过称为 Carvykti REMS 的风险评估和缓解策略 (REMS) 下的受限计划获得。
长期和复发性血细胞减少症:患者在淋巴耗竭化疗和 Carvykti 输注后可能表现出长期和复发性血细胞减少症。一名患者因长期血小板减少而接受了自体干细胞治疗以进行造血重建。
在 CARTITUDE-1 中,30% (29/97) 的患者经历了延长的 3 级或 4 级中性粒细胞减少症,41% (40/97) 的患者经历了延长的 3 级或 4 级血小板减少症,在 ciltacabtagene autoleucel 输注后第 30 天仍未解决。
康复后 63% (61/97)、18% (17/97)、60% (58/97) 和 37% (36/97) 出现复发性 3 或 4 级中性粒细胞减少、血小板减少、淋巴细胞减少和贫血输注后最初的 3 级或 4 级血细胞减少。在 ciltacabtagene autoleucel 输注后第 60 天后,分别有 31%、12% 和 6% 的患者在其 3 级或 4 级血细胞减少症初步恢复后复发了 3 级或更高级别的淋巴细胞减少症、中性粒细胞减少症和血小板减少症。87% (84/97) 的患者在 3 级或 4 级血细胞减少症初始恢复后出现 1 次、2 次或 3 次或更多次 3 级或 4 级血细胞减少症复发。死亡时分别有 6 名和 11 名患者出现 3 级或 4 级中性粒细胞减少症和血小板减少症。
在 Carvykti 输注之前和之后监测血细胞计数。根据当地机构指南,使用生长因子和血液制品输血支持治疗血细胞减少。
感染: Carvykti 不应用于活动性感染或炎症性疾病的患者。Carvykti 输注后患者发生严重、危及生命或致命的感染。
57 名 (59%) 患者发生感染(所有级别)。23% (22/97) 的患者发生 3 级或 4 级感染;17% 的患者发生 3 级或 4 级不明病原体感染,7% 发生病毒感染,1% 发生细菌感染,1% 发生真菌感染。总体而言,四名患者有 5 级感染:肺脓肿 (n=1)、败血症 (n=2) 和肺炎 (n=1)。
在 Carvykti 输注前后监测患者的感染体征和症状,并适当治疗患者。根据标准的机构指南管理预防性、先发制人和/或治疗性抗菌药物。在 ciltacabtagene autoleucel 输注后,10% 的患者出现发热性中性粒细胞减少症,并且可能与 CRS 并发。如果发生发热性中性粒细胞减少症,请评估感染情况,并根据医学指示使用广谱抗生素、补液和其他支持性护理进行管理。
病毒再激活:乙型肝炎病毒 (HBV) 再激活,在某些情况下导致暴发性肝炎、肝功能衰竭和死亡,可能发生在低丙种球蛋白血症患者身上。
在收集用于制造的细胞之前,根据临床指南对巨细胞病毒 (CMV)、HBV、
丙型肝炎病毒 (HCV) 和人类免疫缺陷病毒 (HIV) 或任何其他感染因子进行筛查。根据当地机构指南/临床实践,考虑抗病毒治疗以防止病毒再激活。
12% (12/97) 的患者报告低丙种球蛋白血症为不良事件;92% (89/97) 的患者输注后实验室 IgG 水平降至 500 mg/dL 以下。用 Carvykti 治疗后监测免疫球蛋白水平并对 IgG <400 mg/dL 给予 IVIG。根据当地机构指南进行管理,包括感染预防措施和抗生素或抗病毒预防措施。
使用活疫苗:尚未研究在 Carvykti 治疗期间或之后使用活病毒疫苗进行免疫接种的安全性。不建议在淋巴清除化疗开始前至少 6 周内、在 Carvykti 治疗期间以及在 Carvykti 治疗后免疫恢复之前接种活病毒疫苗。
在ciltacabtagene autoleucel 输注后,5% (5/97) 的患者发生超敏反应。Carvykti 中的二甲基亚砜 (DMSO) 可能导致严重的超敏反应,包括过敏反应。输注后 2 小时应仔细监测患者是否出现严重反应的体征和症状。根据超敏反应的严重程度及时治疗和适当管理。
继发性恶性肿瘤:患者可能发展为继发性恶性肿瘤。终身监测继发性恶性肿瘤。如果发生继发性恶性肿瘤,请致电 1-800-526-7736 联系 Janssen Biotech, Inc. 进行报告并获取有关收集患者样本以检测 T 细胞来源的继发性恶性肿瘤的说明。
对驾驶和使用机器能力的影响:由于潜在的神经系统事件,包括精神状态改变、癫痫发作、神经认知能力下降或神经病变,患者在 Carvykti 输注后的 8 周内有意识或协调能力改变或降低的风险。建议患者不要驾驶和从事危险的职业或活动,例如在此初期操作重型或潜在危险的机器,以及在任何神经系统毒性新发作的情况下。
不良反应
最常见的非实验室不良反应(发生率大于 20%)是发热、细胞因子释放综合征、低丙种球蛋白血症、低血压、肌肉骨骼疼痛、疲劳、不明病原体感染、咳嗽、寒战、腹泻、恶心、脑病、食欲下降、上呼吸道感染、头痛、心动过速、头晕、呼吸困难、水肿、病毒感染、凝血障碍、便秘和呕吐。最常见的实验室不良反应(发生率大于或等于 50%)包括血小板减少、中性粒细胞减少、贫血、转氨酶升高和低白蛋白血症。
请阅读完整的处方信息,包括 Carvykti 的黑框警告。
关于强生旗下的杨森制药公司
在杨森,我们正在创造一个让疾病成为过去的未来。我们是强生旗下的制药公司,我们孜孜不倦地工作,用科学与疾病作斗争,用独创性改善可及性,用心灵治愈绝望,为世界各地的患者实现这一未来。我们专注于我们可以发挥最大作用的医学领域:心血管和代谢、免疫学、传染病和疫苗、神经科学、肿瘤学和肺动脉高压
