公司: Mitsubishi Tanabe Pharma Corporation
批准日期: 2022 年 5 月 12 日
治疗:肌萎缩侧索硬化症
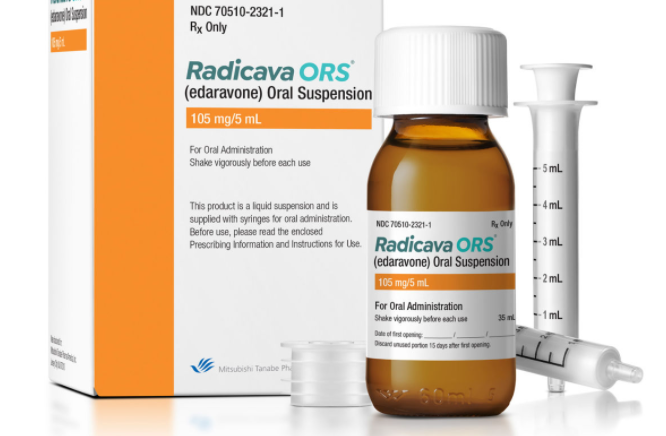
Radicava ORS 是一种自由基清除剂,适用于治疗肌萎缩侧索硬化症 (ALS)。
美国食品药品监督管理局 (FDA) 已批准依达拉奉的口服形式 Radicava ORS (edaravone) 用于治疗肌萎缩侧索硬化症(ALS),一种神经退行性疾病,目前无法治愈,并且可以迅速发展。1,2 Radicava ORS 提供与 Radicava(依达拉奉)相同的功效,这是一种 FDA 批准的静脉 (IV) 治疗,在一项关键试验中显示,有助于减缓 ALS 身体功能的丧失。
“在 MTPA,患者一直是我们工作的推动力,我们努力为 ALS 开发有意义的治疗方案并继续解决未满足的需求,” MTPA 总裁Atsushi Fujimoto说。“五年前,我们自豪地推出了 Radicava,作为美国 ALS 患者的治疗选择。现在,我们继续通过 Radicava ORS 推动创新的界限,这是一种口服给药选择,使患者可以灵活地服用药物。”
Radicava ORS 专为 ALS 患者配制,提供灵活的给药选择(口服或通过饲管服用),小剂量 5 mL、便携式瓶、口服给药注射器,患者服用前无需冷藏或重构. 1在医疗保健提供者 (HCP) 的适当指导下,Radicava ORS 在治疗日可能只需几分钟即可给药。Radicava ORS 应在隔夜禁食后的早晨服用。
田纳西大学健康科学中心神经病学教授Tulio Bertorini医学博士说:“ALS 是一种进行性疾病,由于其异质性,以不同的速度影响具有不同症状的患者。” “因此,患者有适合自己独特需求的治疗和配方选择至关重要,Radicava ORS 为已经为 ALS 患者开具依达拉奉处方的 HCP 提供替代递送选择。”
依达拉奉在 ALS 中的综合临床开发计划已跨越十多年,其中包括针对静脉注射和口服制剂的多项临床试验。FDA 对 Radicava 口服补液盐的批准得到了几项研究的支持,其中包括来自关键 3 期临床试验 (MCI186-19) 的数据,该试验评估了 137 名 ALS 患者,这些患者显示使用 Radicava 治疗可将身体功能的丧失减慢 33%(约三分之一)与 24 周时的安慰剂相比,由 ALS 功能评定量表修订版 (ALSFRS-R) 测量,这是一种经过验证的用于监测患者疾病进展的评定工具。此外,还进行了七项 1 期临床药理学研究,以检查 Radicava ORS 在有和没有经皮内窥镜胃造口术 (PEG) 管的健康个体和 ALS 患者中的药代动力学、安全性、药物间相互作用、剂量、生物利用度和生物等效性/鼻胃(NG)管,以及一项为期 24 周的全球 3 期试验,证明了 185 名 ALS 患者治疗的安全性和耐受性。最后,正在进行一项 3 期研究,评估 Radicava ORS 长达 96 周的长期安全性和耐受性。
在接受 Radicava 治疗的患者中,超过 10% 的患者最常见的不良事件是瘀伤(挫伤)、行走问题(步态障碍)和头痛。1服用 Radicava ORS 的患者中有 7.6% 出现疲劳。1 Radicava 和 Radicava ORS 禁用于对依达拉奉或本产品的任何非活性成分有过敏史的患者。1在接受 Radicava 治疗的患者中报告了超敏反应和过敏反应。
ALS 协会总裁兼首席执行官 Calaneet Balas 说:“为了解决 ALS 未满足的需求,我们必须继续寻找新的治疗方法,并优化当前的治疗和护理。” “我们感谢 MTPA 和 FDA 努力使这种口服制剂成为可能,并相信这将是一个受欢迎的补充,有助于进一步支持 ALS 社区。”
作为 MTPA 帮助 ALS 患者使用 Radicava 和 Radicava ORS 的承诺的一部分,MTPA 创建了JourneyMate Support Program ™,该计划提供资源以帮助患者和护理人员进行 ALS 治疗。
JourneyMate 支持计划™为正在考虑或已经使用 MTPA 产品的患者提供教育支持和资源。经验丰富的项目团队成员接受培训,以解决患者和护理人员的教育需求,并为他们提供与 ALS 一起生活的个性化答案和资源。
ALS 资源专家:JourneyMate 支持计划™中的首选资源,可获取有关 ALS 和 Radicava ORS 的一般信息。
保险和获取专家:该专家可以帮助患者和护理人员了解保险范围、财务支持选项、护理地点、专业药房选项以及获取 Radicava ORS 处方的步骤。
ALS 临床教育者:一旦开出 Radicava ORS,ALS 临床教育者可以为患者及其家人提供有关 Radicava ORS 的个性化教育,还将在整个治疗过程中提供资源。
关于 Radicava ®(依达拉奉)和 Radicava ORS ®(依达拉奉)
美国食品药品监督管理局(FDA)于2017 年 5 月 5 日批准 Radicava ®(依达拉奉) ,并于2022 年 5 月 12 日批准了口服制剂 Radicava ORS ®(依达拉奉), 用于治疗肌萎缩侧索硬化症 (ALS)。Radicava 通过静脉输注以 28 天的周期给药。每 60 毫克剂量需要 60 分钟。对于初始周期,连续 14 天每天输注治疗,然后是两周的无药物期。此后的所有周期在 14 天内每天输注 10 天,然后是两周的无药物期。Radicava ORS 每天服用,连续 14 天,随后在初始治疗周期进行 14 天的无药物治疗。对于随后的治疗周期,Radicava ORS 在 14 天内服用 10 天,然后是 14 天的无药期。Radicava ORS 应在隔夜禁食后的早晨服用。服用 Radicava ORS 后一小时内患者不应进食或饮水(水除外)。
依达拉奉由 Mitsubishi Tanabe Pharma Corporation (MTPC) 和 Mitsubishi Tanabe Pharma Development America, Inc (MTDA) 发现和开发用于 ALS,并由 Mitsubishi Tanabe Pharma America, Inc (MTPA) 在美国商业化。MTPC 集团公司于 2001 年开始通过迭代临床平台研究 ALS,历时 13 年。2015年,Radicava在日本和韩国被批准用于治疗ALS 。随后在加拿大(2018 年 10 月)、瑞士(2019 年 1 月)、中国(2019 年 7 月)、印度尼西亚(2020 年 7 月)、泰国(2021 年 4 月)和马来西亚(2021 年 12 月)。迄今为止,在美国,Radicava 已被用于治疗 6,500 多名患者,治疗时间近 100 万天,并已被 1,600 多名 HCP 开具处方。7
重要安全信息
过敏反应
Radicava(依达拉奉)和 Radicava ORS(依达拉奉)禁用于对依达拉奉或该产品的任何非活性成分有过敏史的患者。Radicava曾发生过敏反应(发红、风团和多形性红斑)和过敏反应病例(荨麻疹、血压降低和呼吸困难)。
应仔细监测患者的超敏反应。如果发生超敏反应,停止 Radicava 或 Radicava ORS,按照护理标准进行治疗,并监测直至病情消退。
亚硫酸盐过敏反应
Radicava 和 Radicava ORS 含有亚硫酸氢钠,这是一种亚硫酸盐,可引起过敏性反应,包括过敏症状和危及生命的易感人群或不太严重的哮喘发作。一般人群中亚硫酸盐敏感性的总体患病率尚不清楚,但在哮喘患者中更常见。
不良反应
在 Radicava 治疗的患者中报告的最常见不良反应 (≥10%) 是挫伤 (15%)、步态障碍 (13%) 和头痛 (10%)。在一项开放标签研究中,7.6% 的接受 Radicava ORS 的患者也观察到疲劳。
怀孕
根据动物数据,Radicava 和 Radicava ORS 可能对胎儿造成伤害。
适应症
Radicava 和Radicava ORS 适用于治疗肌萎缩侧索硬化症 (ALS)。
关于 JourneyMate Support Program™
JourneyMate Support Program™为正在考虑或已经使用 MTPA 产品的患者提供教育支持和资源。ALS 临床教育者是一种教育资源,适用于已开具 Mitsubishi Tanabe Pharma America, Inc. (MTPA) 产品的患者。ALS 临床教育者由 MTPA 和 VMS 提供,不隶属于医生或由医生提供。ALS 临床教育者不提供医疗建议。该计划不提供医疗建议,也不代替患者的医生。所有关于病情、诊断或治疗的问题都应提交给患者的医生。
关于 Mitsubishi Tanabe Pharma America, Inc.
位于新泽西州泽西市的 Mitsubishi Tanabe Pharma America, Inc. (MTPA) 是 Mitsubishi Tanabe Pharma Corporation (MTPC) 100% 拥有的美国控股公司 Mitsubishi Tanabe Pharma Holdings 的全资子公司America, Inc. 它由 MTPC 成立,旨在将获批的药品在北美商业化。
关于 Mitsubishi Tanabe Pharma Development America, Inc.
Mitsubishi Tanabe Pharma Development America, Inc. (MTDA) 美国总部位于新泽西州泽西市。MTDA 是 Mitsubishi Tanabe Pharma Corporation 100% 持股的美国控股公司 Mitsubishi Tanabe Pharma Holdings America, Inc. 的全资子公司。
关于 Mitsubishi Tanabe Pharma Corporation
三菱化学控股集团 (MCHC Group) 的制药部门 Mitsubishi Tanabe Pharma Corporation (MTPC) 是世界上最古老的制药公司之一,成立于 1678 年,专注于伦理药品。MTPC 总部位于日本的发源地大阪道正町。制药业。母婴健康院集团将医疗保健作为其经营方针“打造未来”的战略重点。MTPC设定了“为所有面临疾病的人创造希望”的使命。为此,MTPC正在优先开展“精准医疗”工作,通过识别具有高疗效和安全性潜力的患者群体,重点关注中枢神经系统和免疫炎症等疾病领域,为患者提供高治疗满意度的药物。此外,MTPC 正致力于开发“围绕药丸解决方案”,以解决基于治疗医学的特定患者问题,包括疾病预防、症状前疾病护理、预防恶化和预后。
1 Radicava 和 Radicava ORS 处方信息。新泽西州泽西市:Mitsubishi Tanabe Pharma America, Inc.;2022.
2 “肌萎缩侧索硬化 (ALS) 情况说明书”。国家神经疾病和中风研究所,国家卫生研究院,2013 年 6 月,https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-Sheets/Amyotrophic-Lateral-Sclerosis-ALS-Fact-。
3依达拉奉 (MCI-186) ALS 19 研究组。依达拉奉在明确定义的肌萎缩侧索硬化患者中的安全性和有效性:一项随机、双盲、安慰剂对照试验。柳叶刀神经元。2017;16(7):505-512。
4鲁特科夫 SB。肌萎缩侧索硬化症疾病进展的临床测量。神经治疗学。2015;12(2):384-393。
5 ClinicalTrials.gov. 2019. ALS 受试者口服依达拉奉的安全性研究。https://clinicaltrials.gov/ct2/show/NCT04165824。
6 ClinicalTrials.gov. 2020. 肌萎缩侧索硬化症 (ALS) 受试者口服依达拉奉的安全性扩展研究。https://clinicaltrials.gov/ct2/show/NCT04577404。
7存档数据。三菱田边制药美国公司
消息来源 Mitsubishi Tanabe Pharma America, Inc.
