抗体偶联药物(ADC)不是一个新鲜话题,从第一个ADC药物(Mylotarg)被FDA批准(2000年)至今已经有20年的历史,研发到临床的路径无比艰难,期间被酪氨酸激酶(TKIs)、PD-1/PD-L1抑制剂和CAR-T的热浪不断冲击,但是科学家和临床医生始终没有放弃ADC这个品类药物的研发。
I 抗体偶联药物的诞生

(Paul Ehrlich来源:wiki)

图片:诺贝尔奖官网
100多年前,诺贝尔物理或医学奖得主保罗·埃尔利希(Paul Ehrlich)提出了“魔法子弹”的概念。他认为,如果将能杀死癌细胞的药物安装在特异性靶向癌细胞的载体上,就能实现定向打击癌细胞,而不伤害人体正常细胞,实现有效性大大提高而减少“脱靶效应”引起的副反应,可是说是最早期的“肿瘤精准治疗”理念。
Ehrlich的超前治疗理念,需要技术的支持,否则只能停留在概念阶段。单克隆抗体的出现,让“定向打击”成为可能。1984年12月8日因确立免疫系统发生和控制特异性的机制和生产单克隆抗体的基本原则,科勒尔(Georges J.F. Kohler)、杰尼(Niels K, Jerne)和米尔斯坦(Cesar Milstein)三位科学家共同获得1984年诺贝尔生理或医学奖。伴随着单抗类药物诞生的,由此衍生的—抗体偶联药物,进入科学家的视线。
I 抗体偶联药物的起步和繁荣
2000年,Gemtuzumab ozogamicin成为第一个获得FDA批准的抗体偶联药物,也是常说的第一代抗体偶联药物。不过因Gemtuzumab ozogamicin副作用较大于2010年撤市,2017年重新获批上市。2011年,第二代抗体偶联药物维布妥昔单抗(Brentuximab vedotin)获得FDA的批准,用于治疗霍奇金淋巴瘤和复发性间变性大细胞淋巴瘤。至今已经扩展到6个适应症,均针对CD30阳性的相关淋巴瘤。
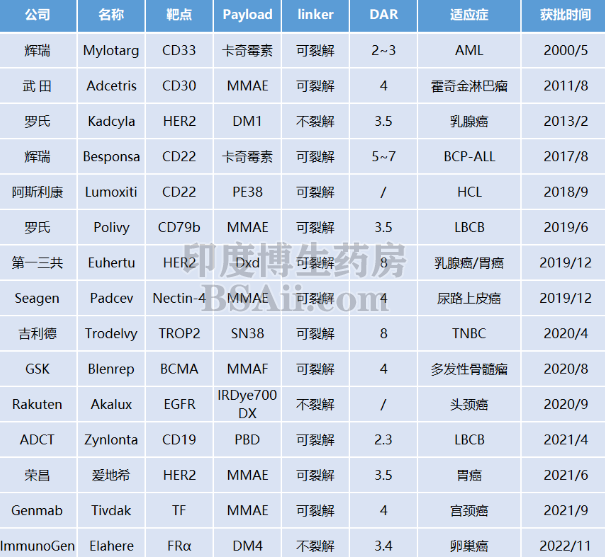
2019年12月FDA批准了Padcev和Enhertu2款ADC药物,至此抗体偶联药物的研发和产出进入繁荣期, 抗体偶联药物(ADC)的小春天 有完整介绍。
I 维布妥昔单抗的三套件
从 Ehrlich对“魔法子弹”的描述中,我们不难看出,抗体偶联药物这颗“魔法子弹”由三部分组成(三套件):单抗,化疗药物,以及将前面二位连接起来的元件(linker)。三套件各司其职,完成杀伤肿瘤细胞的整个过程。基本原理如下:
抗体偶联药物的靶向性来自其中抗体部分(antibody),毒性大部分来自小分子化药毒物部分(payload),抗体部分也可以自带毒性(ADCC与CDC)。抗体部分与毒素部分通过连接物(linker)互相连接。抗体部分与肿瘤细胞表面的靶向抗原结合(binding)后,肿瘤细胞会将ADC内吞(endocytosis)。之后ADC药物会在溶酶体中分解(lysosomal degradation),释放出活性的化药毒物,破坏DNA或阻止肿瘤细胞分裂,起到杀死细胞的作用。理想化的连接物应该保持稳定所以不会导致靶外毒性(off-target toxicity),并且在细胞内高效释放毒物。
套件1 单抗:维布妥昔单抗选择了靶向CD-30的单抗
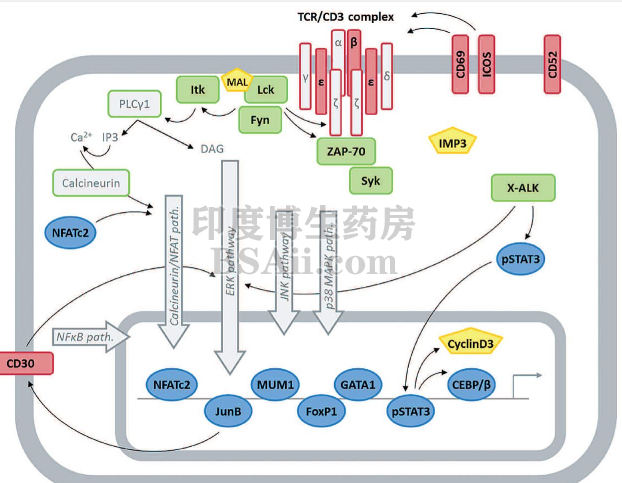
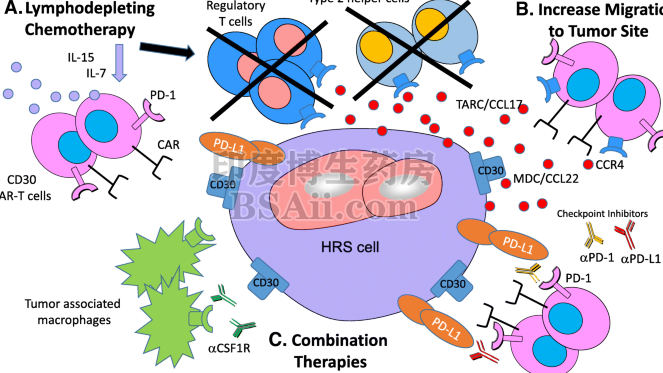
CD30是肿瘤坏死因子受体(TNFR)超家族的一种跨膜蛋白,研究证明多个恶性肿瘤表达CD-30,比如霍奇金淋巴瘤,间变性大细胞淋巴瘤(ALCL),B细胞来源的非霍奇金淋巴瘤的某些亚型,以及成熟的T细胞淋巴瘤等。 CD30在淋巴细胞亚群中受限制的表达,让它成为治疗淋巴系统肿瘤的理想靶点,选择CD-30,理论上可以实现对上述肿瘤的“精准打击”。
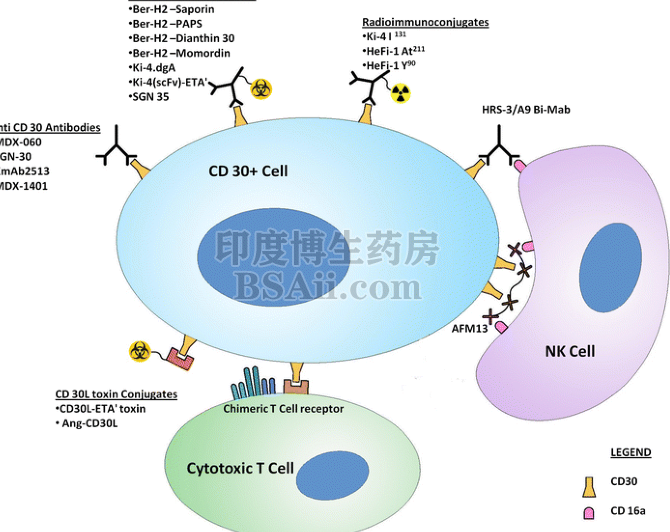
CD30信号通路,图源:10.1038/nrc2291
套件2-细胞毒素: 维布妥昔单抗选择了 Monomethyl auristatin E(MMAE)
MMAE是奥瑞他汀类的微管蛋白活性抑制剂。它能使癌细胞在有丝分裂期,两个子细胞不能正常分配遗传物质,从而导致癌细胞分裂半途而废,最终癌细胞因遗传物质混乱而死[2]
维布妥昔单抗的“三套件”结构示意图,图源:10.1038/nrd.2016.268
那么MMAE是如何挂在CD30单抗cAC10上形成维布妥昔单抗的呢?
套件3 连接子(linker): 维布妥昔单抗的选择是瓜氨酸-缬氨酸组成的二肽连接子
作为ADC药物的连接子需要具备2种基本特性, 第一,连接抗体与药物的元件不能影响到药物本身的作用;第二,为了尽可能的减小药物的副作用,连接子不能在药物还在血液里时就断了。
对于维布妥昔单抗而言,满足上述两个条件的是由瓜氨酸-缬氨酸组成的二肽连接子, 该 二肽的连接子足够小,基本不会影响到单抗和MMAE; 该二肽在血浆中高度稳定,在被CD30阳性细胞内化后可被溶酶体酶快速有效地切割,发挥杀灭癌细胞的作用。 该偶联技术为西雅图遗传学公司的专有技术。
I 维布妥昔单抗的特点
1 MMAE毒杀肿瘤细胞
关于这一特点,简单的描述是这样的:医生将维布妥昔单抗注射到患者体内之后,在CD30抗体的导航下,维布妥昔单抗迅速锁定携带CD30的癌细胞,并于CD30结合;紧接着,癌细胞会把维布妥昔单抗吞进细胞内部,遇到细胞内部的溶酶体酶之后,二肽连接子就会被切断,MMAE立即抑制微管蛋白活性,让癌细胞的分裂半途而废,最终混乱而死[3]。
2 MMAE旁杀肿瘤组织细胞
肿瘤里面不仅有癌细胞,还有很多肿瘤基质细胞,它们支撑着肿瘤的生长的发展,对肿瘤非常重要,消灭它们能在一定程度上起到打击肿瘤的作用。
在MMAE杀死癌细胞之后,随着癌细胞破裂,释放到肿瘤微环境中。这个MMAE还有个特点,它可以自由穿过细胞膜。这就意味着,被癌细胞释放的一部分MMAE,会自由渗透到肿瘤的其他细胞中,包括CD30阴性的癌细胞,肿瘤相关的其他各种基质细胞,都有可能被MMAE毒杀。
3 CD30单抗的ADCP效应
维布妥昔单抗中的CD30抗体并不简单,它不仅是MMAE的定向运载工具,还是癌细胞的催命符。对于CD30单抗cAC10而言,它作为一个单抗,本身还具有抗体依赖性细胞吞噬作用(ADCP)。啥意思呢,就是cAC10结合在癌细胞表面之后,会召集巨噬细胞等吃掉癌细胞。除此之外,CD30单抗cAC10还有个技能是阻断CD30相关的信号通路,这一招也能抑制肿瘤的生长。
4 联合PD-1抑制剂增强疗效
一般情况下,正常的细胞死亡都是非免疫原性的,不会促发大规模的免疫反应。但是研究表明维布妥昔单抗可以诱导免疫原性细胞死亡,释放一些免疫相关信号分子,重启肿瘤微环境中被抑制的免疫反应。研究人员甚至已经发现,维布妥昔单抗治疗可以增加细胞毒性T细胞和NK细胞的数量,与PD-1抗体联合使用,抗癌效果更强大。

I FDA批准的维布妥昔单抗适应症
维布妥昔单抗是由靶向CD30蛋白的一种单克隆抗体和一种微管破坏剂(单甲基auristatin E,MMAE)通过一种蛋白酶敏感的交联剂偶联而成的ADC药物,该偶联技术为西雅图遗传学公司的专有技术。CD30蛋白是经典HL的明确标志物,Auristatin E可通过抑制微管蛋白的聚合作用阻碍细胞分裂。Adcetris在血液中可稳定存在,在被CD30阳性肿瘤细胞内化后,可释放出MMAE。FDA根据一系列临床研究结果,陆续批准了以下6种适应症。
第一种CD-30阳性淋巴瘤:经典型霍奇金淋巴瘤(Classical HodgkinLymphoma, cHL)。
1. 适应症为与多柔比星、长春新碱和达卡巴嗪化疗方案联合治疗未经前序治疗的III期或IV期经典型霍奇金淋巴瘤(意思是与AVD方案联合一线治疗)
2. 用于治疗高复发风险或自体干细胞骨髓移植(auto-HSCT)进展后的经典型霍奇金淋巴瘤
3. 用于治疗自体骨髓移植失败后或不适合自体骨髓移植的至少2次前序化疗失败后的经典型霍奇金淋巴瘤
第二种淋巴瘤:CD-30阳性的非霍奇金淋巴瘤(NHL)
4. 与环磷酰胺、多柔比星和强的松联合用于治疗未经前序治疗的系统性间变大细胞淋巴瘤或其他CD-30阳性的外周T细胞淋巴瘤(PTCL),包括血管免疫母细胞性T细胞淋巴瘤和未分类PTCL(意思是与化疗联合一线治疗CD-30阳性的外周T细胞淋巴瘤)
5. 用于治疗至少一次化疗方案失败后的系统性间变大细胞淋巴瘤
第三种淋巴瘤:原发性皮肤间变大细胞淋巴瘤或CD-30阳性的蕈样真菌病(MF)
6. 用于治疗前序治疗后的原发性皮肤间变大细胞淋巴瘤或CD-30阳性的蕈样真菌病(MF)
参考文献
[1]Francisco J A, Cerveny C G, Meyer D L, et al. cAC10-vcMMAE, ananti-CD30–monomethyl auristatin E conjugate with potent and selective antitumoractivity[J]. Blood, 2003, 102(4): 1458-1465.
[2]Teo EC, Chew Y, Phipps C. A review of monoclonal antibody therapies in lymphoma[J]. Crit Ver Oncol Hematol, 2016, 97(1): 72-84.
[3] FDA adcetris label
注射维布妥昔单抗后腹泻咋办?
维布妥昔单抗不能和什么药物一起使用?
维布妥昔单抗多久一疗程?
维布妥昔单抗哪些患者不宜使用?
注射维布妥昔单抗需要做哪些检查?
维布妥昔单抗有哪些副作用?
维布妥昔单抗的使用剂量标准是?
维布妥昔单抗/本妥昔单抗怎么注射?
安适利/维布妥昔单抗怎么保存?
治疗霍奇金淋巴瘤(cHL)的9款单抗药物