Koselugo(Selumetinib)司美替尼 适用于2岁及以上患有1型神经纤维瘤病(NF1),治疗无法手术的丛状神经纤维瘤(PN)的儿童患者。
剂型:胶囊
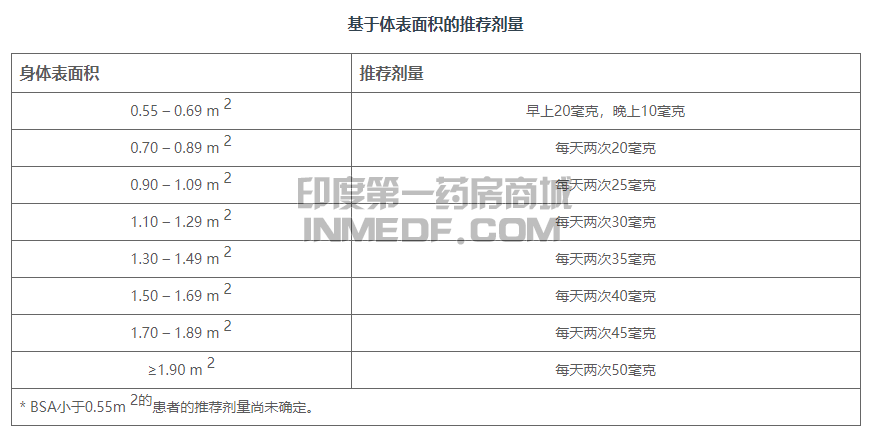
推荐剂量
以下为根据体表面积(BSA)推荐的司美替尼(Selumetinib)服用剂量。
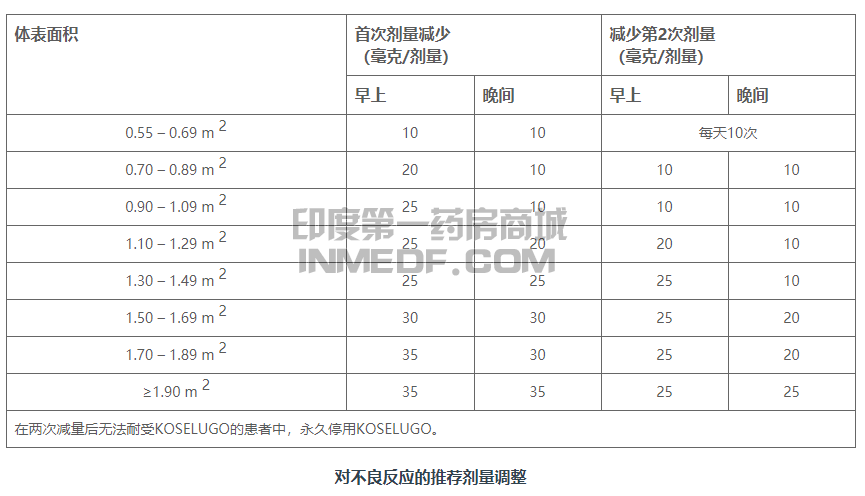
不良反应的剂量调整
减少不良反应的推荐剂量
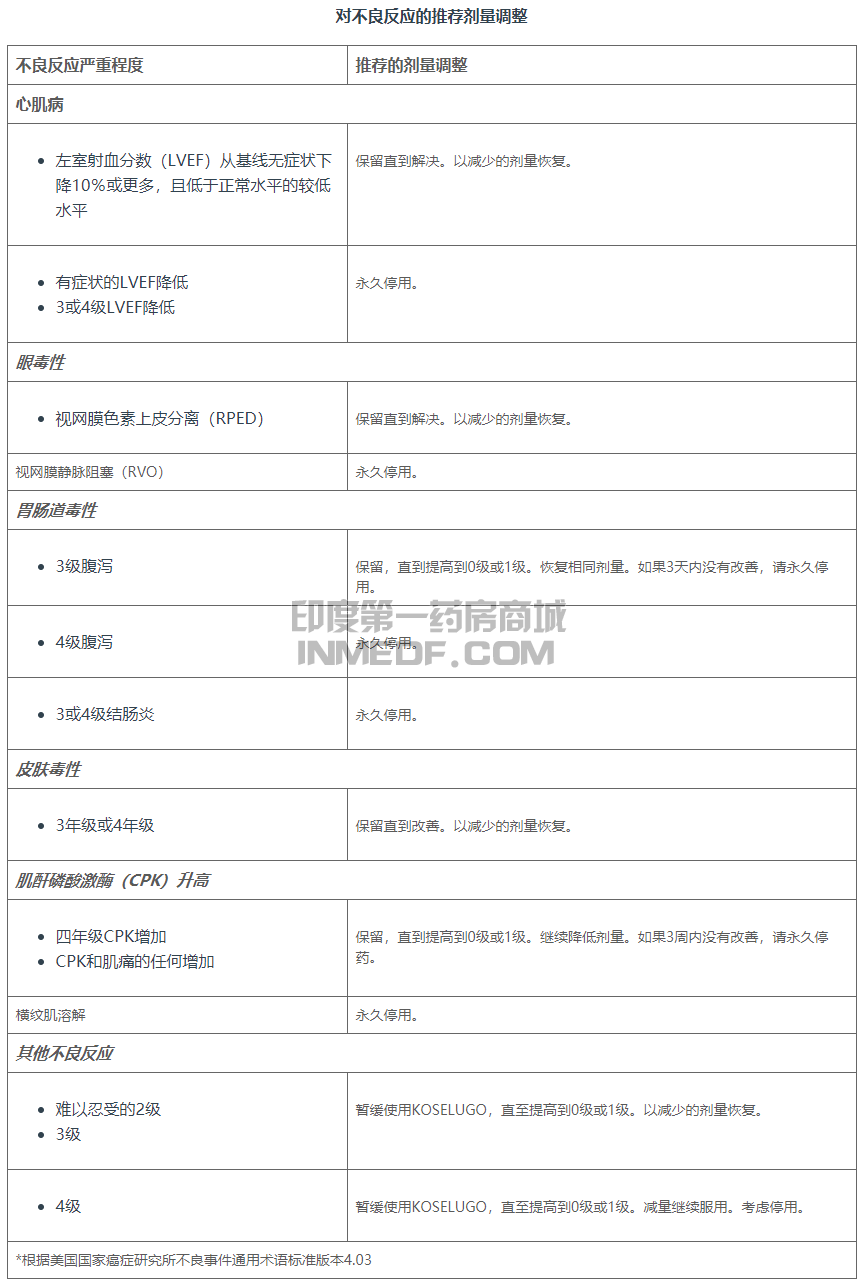
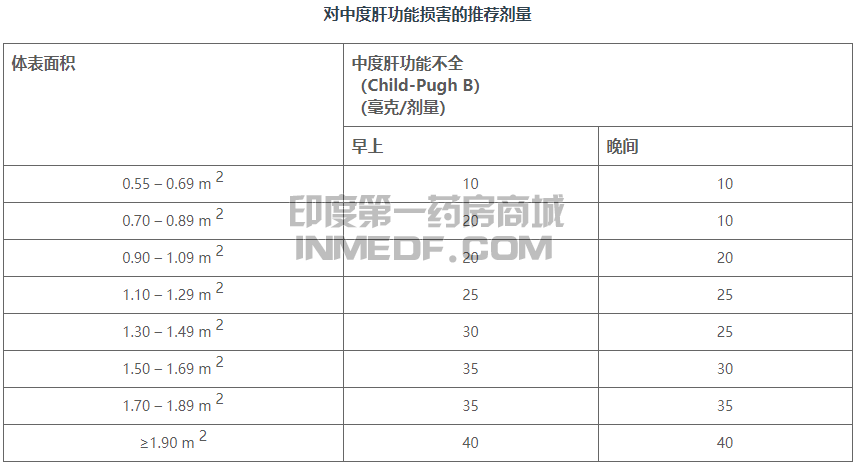
对于中度肝功能不全的患者(Child-Pugh B),每天2次口服KOSELUGO的推荐剂量降至20mg/m 2。尚未确定用于严重肝功能不全(Child-Pugh C)患者的推荐剂量司美替尼(Selumetinib) 。
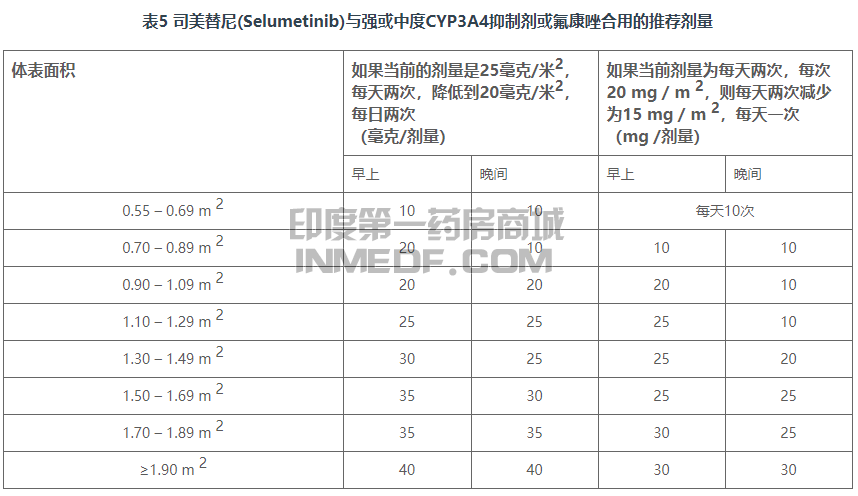
避免将强效或中效CYP3A4抑制剂或氟康唑与司美替尼(Selumetinib)并用。如果不能避免与强效或中效CYP3A4抑制剂或氟康唑合用,则按表5的建议减少司美替尼(Selumetinib)的剂量。在终止强效或中度CYP3A4抑制剂或氟康唑(fluconazole)的3种消除半衰期后,恢复之前服用的KOSELUGO剂量引发抑制剂或氟康唑。
储存在25°C(77°F); 允许在15°C到30°C(59°F到86°F)之间的偏移。
原瓶储藏,请勿去除干燥剂。防潮。
标签上其他地方描述了以下临床上显着的不良反应:
临床试验经验
由于临床试验是在变化很大的条件下进行的,因此不能将在某种药物的临床试验中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
警告和注意事项中的数据反映了74名儿科患者的KOSELUGO暴露量,这些患者每天两次在SPRINT中口服20mg/m2至30mg/m2的剂量。在这些患者中,包括剂量中断在内的KOSELUGO暴露持续时间为12个月或更长时间(91%),超过2年(74%)或超过4年(23%)。警告和注意事项还包括其他临床试验中成年和儿科患者的其他数据,这些成人和儿科患者在各种肿瘤中均接受了不同剂量的KOSELUGO给药。
1型神经纤维瘤病(NF1)不能手术的盆状神经纤维瘤(PN)
在SPRINT II期1层中评估了KOSELUGO的安全性。符合条件的患者年龄在2-18岁之间,患有无法手术的PN,导致严重的发病率。排除以下患者:LVEF异常,高血压不受控制(血压≥年龄,身高和性别的95%),RVO或RPED的任何当前或过去的病史,眼压 > 21 mmHg(或根据年龄调整的正常上限) ,不受控制的青光眼,无法吞服整个胶囊。患者每天口服两次KOSELUGO 25 mg / m 2(n = 50)。在这些患者中,有88%暴露了12个月或更长时间,有66%暴露了2年以上。
接受KOSELUGO的患者中有24%发生严重的不良反应。在2个或更多患者中发生的严重不良反应为贫血,缺氧和腹泻。
接受KOSELUGO治疗的患者中有12%因不良反应而永久停药。导致KOSELUGO永久停用的不良反应包括肌酐增加,体重增加,腹泻,甲沟炎,恶性周围神经鞘瘤,急性肾损伤和皮肤溃疡。
80%和24%的接受KOSELUGO的患者因不良反应导致剂量中断和剂量减少。需要中断剂量或减少≥5%的患者的不良反应为呕吐,甲沟炎,腹泻,恶心,腹痛,皮疹,皮肤感染,流感样疾病,发热和体重增加。
最常见的不良反应(≥40%)为呕吐,皮疹(全部),腹痛,腹泻,恶心,皮肤干燥,疲劳,肌肉骨骼疼痛,发热,痤疮样皮疹,口腔炎,头痛,甲沟炎和瘙痒。