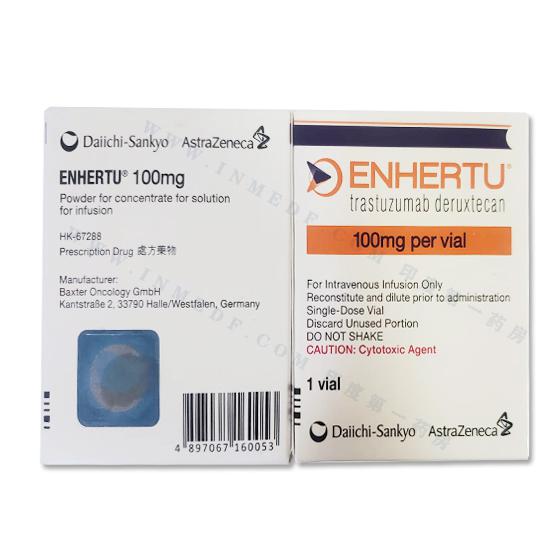
ENHERTU(港版DS8201)trastuzumab/deruxtecan100mg
¥15900.00 热度:373 原价:26000.00选择 规格/运费
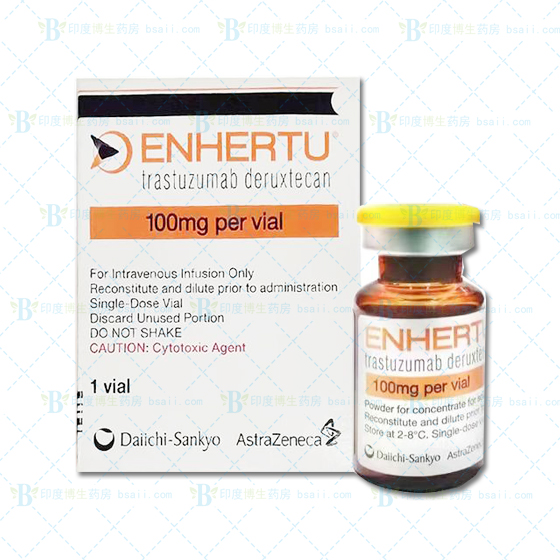
商品编号:1648610351
- 100mg/1盒/支
- 请先与客服协商物流方式
参数 详细信息
药品参数
| 生产企业 | AstraZeneca&Daiichi Sankyo |
|---|---|
| 通用名称 | ENHERTU(港版DS8201) |
| 主要原料 | trastuzumab/deruxtecan100mg |
| 治疗作用 | HER2阳性的乳腺癌、胃癌或胃食管连接部.. |
| 温馨提示 | 请在医务人员的指导下使用。 |
必读 消费告知书
了解 关于印度博生药房