
Mobocertinib(TAK-788,商品名EXKIVITY)是武田(Takeda)制药的一款口服EGFR酪氨酸激酶抑制剂。2021 年9 月15 日,美国FDA 加速批准Mobocertinib上市,用于治疗在含铂化疗治疗期间或治疗后进展的局部晚期或转移性的,EGFR外显子20插入突变阳性的非小细胞肺癌(NSCLC )成年患者。
剂量和给药方法
※推荐剂量
160mg每天一次,空腹或随餐口服,应整片用水送服,不可打开、咀嚼或溶解胶囊。如果漏服超过当日服药时间6小时以上或呕吐,不可补服,下次服药仍按照原间隔时间。
※剂量调整
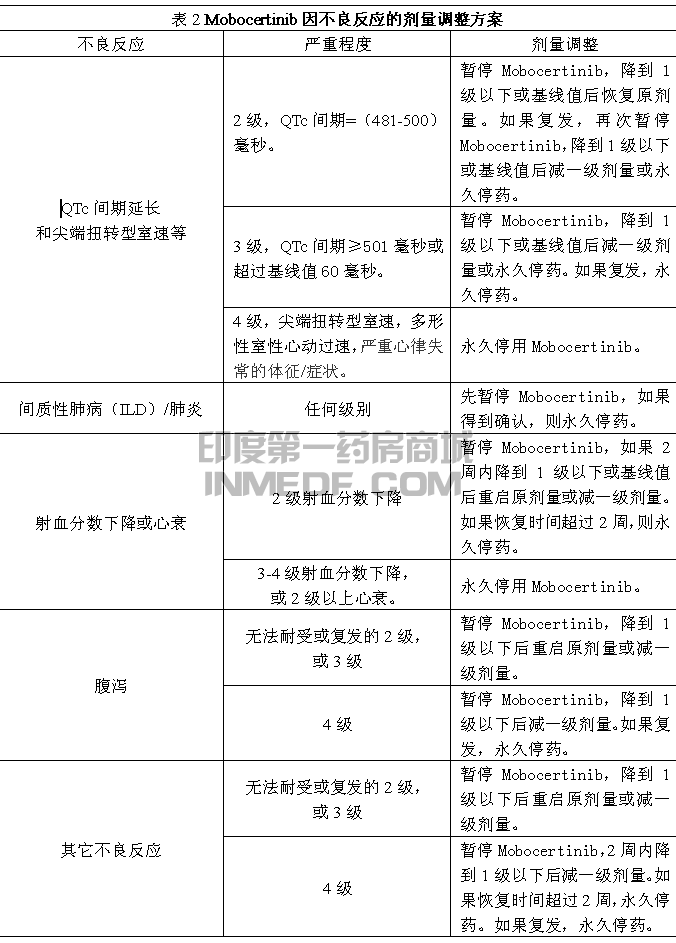
基于每个患者的安全性和耐受性,可能需要停药和/或降低剂量,推荐减量方法见表1,因不良反应的剂量调整方案见表2,如果仍无法耐受80mg每天一次,永久停药。

避免与中效或强效CYP3A 抑制剂同服,如果不可避免服用中效CYP3A 抑制剂,Mobocertinib应减一级剂量服用。在停用中效CYP3A 抑制剂3-5 个半衰期后,Mobocertinib恢复至原剂量水平。
剂型和规格
胶囊:40 mg。白色,2号胶囊。
不良反应和注意事项
※QTc间期延长和尖端扭转型室速
Mobocertinib可能导致威胁生命的QTc间期延长和尖端扭转型室速。临床试验中患者的QTc间期基线值均不超过470毫秒,250例患者中,有1.2%患者的QTc间期延长>500毫秒,11%患者的QTc间期延长超过基线值60毫秒,1例(0.4%)患者发生4级尖端扭转型室速。
在服用Mobocertinib前,检测患者的QTc间期、心电图和血清中电解质。服用Mobocertinib期间,定期检测QTc间期和血清中电解质。如果患者有先天性QTc间期延长、心脏疾病或电解质异常,增加检测频率。避免同服可延长QTc间隔的药物。避免与中效或强效CYP3A抑制剂同服。
※间质性肺病(ILD)/肺炎
临床试验有4.3%患者发生间质性肺病(ILD)/肺炎,3级0.3%,1.2%致命。分别导致给药2.8月和9.8月后永久停药。如果发现患者出现疑似间质性肺病/肺炎的症状,如呼吸困难、咳嗽和发烧等,立即停药,并及时去医院检查。如果确诊为间质性肺疾病/间质性肺炎,应永久停用Mobocertinib,并应进行适当的治疗。
※心脏毒性
Mobocertinib可能有心脏毒性(包括射血分数下降,心肌病和充血性心衰等)导致心衰,并可能致命。临床试验有2.7%患者发生心衰,其中3级1.2%,4级0.4%,致命1例。
尖端扭转型室速见前述。心房颤动1.6%,室性心动过速0.4%,一度房室传导阻滞0.4%,二度房室传导阻滞0.4%,左束支传导阻滞0.4%,室上性期外收缩0.4%和室性早搏0.4%。
在服用Mobocertinib前和期间,检测患者的射血分数和其它心脏功能。
※腹泻
临床试验中,腹泻发生比例较高(所有级别93%,3级20%,4级0.4%)。中位首次发生腹泻时间为5天。在48%的腹泻缓解患者中,中位缓解时间为3天。
腹泻可能导致脱水或电解质异常,可能伴有肾功能异常。在患者发生腹泻时,推荐使用洛哌丁胺(易蒙停)等止泻药物,并补充水分和电解质。
※胚胎-胎儿毒性
动物试验提示,Mobocertinib对胚胎有致命毒性。不建议孕妇服用该药,哺乳母亲在服药期间和停药一个月内应停止哺乳。患者和伴侣应在服药期间和停药一月内,使用有效的避孕措施。
※常见不良反应
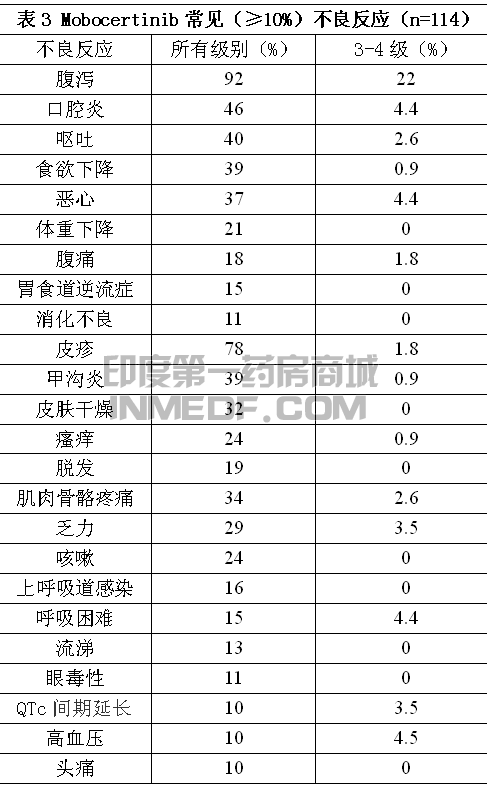
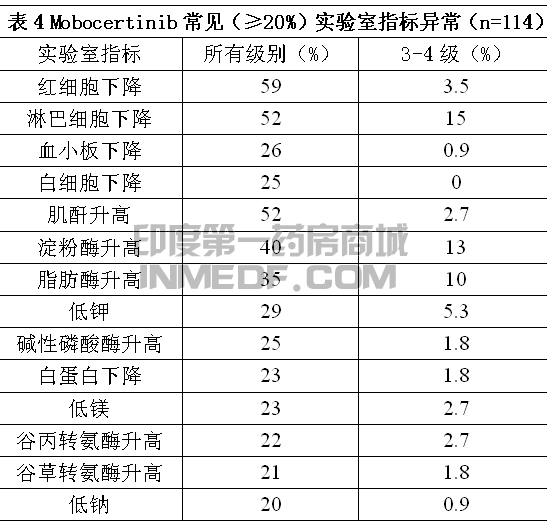
合并安全性人群为256例服用Mobocertinib 160mg每天一次单药的实体瘤患者,48%服药超过半年,12%服药超过一年。最常见(>20%)不良反应为腹泻、皮疹、恶心、口腔炎、呕吐、食欲下降、甲沟炎、乏力、皮肤干燥和肌肉骨骼疼痛。最常见(≥2%)3级或4级实验室指标异常为淋巴细胞下降、淀粉酶升高、脂肪酶升高、低钾、血红蛋白下降、肌酐升高和低镁。
AP32788-15-101研究,114例EGFR外显子20插入突变的局部晚期或转移性NSCLC患者,Mobocertinib160mg每天一次,60%的患者服药超过半年,14%的患者服药超过一年。
46%的患者发生严重不良反应,最常见(≥2%)的严重不良反应为腹泻、呼吸困难、呕吐、发热、急性肾功能损伤、恶心、胸水和心衰。1.8%的患者发生致命不良反应,包括心衰(0.9%)和肺炎(0.9%)。17%的患者永久停药,最常见的原因为腹泻和恶心。51%的患者暂停给药,最常见的原因为腹泻、恶心和呕吐。25%的患者减量,常见的原因为腹泻。
EGFR外显子20插入突变NSCLC患者的不良反应具体见表3和表4。
药代动力学
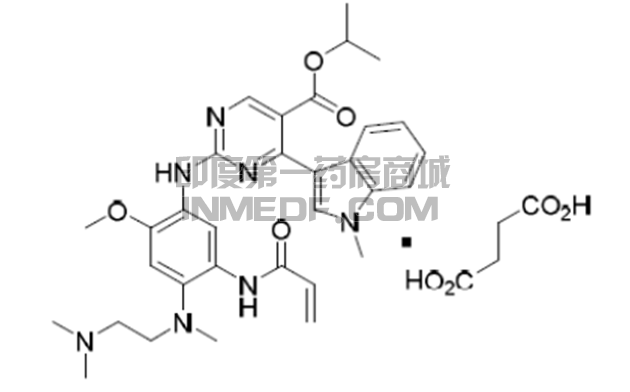
一粒40 mgMobocertinib胶囊包含48.06mgMobocertinib琥珀酸盐(分子量703.8 g/mol)。Mobocertinib不含手性中心。Mobocertinib是EGFR/HER2/HER4/BLK抑制剂,可与EGFR 外显子20插入突变不可逆地结合。活性代谢物AP32960和AP32914具有和Mobocertinib类似的靶点抑制特性。
Mobocertinib的绝对生物利用度37%,服药4小时后达到血药浓度峰值,平均半衰期为18小时。Mobocertinib 160mg每天一次连续服用时,没有发现蓄积。血浆蛋白结合率99.3%,表观分布体积3509升。
Mobocertinib单次160mg给药后,粪便中76%(6%为无变化的Mobocertinib),尿中4%(1%为无变化的Mobocertinib)。AP32960在粪便中12%,在尿中1%。AP32914在粪便和尿中未检出。
食物对Mobocertinib的生物利用度没有临床意义上的影响。
Mobocertinib 160mg每天一次时,QTc间期的最大平均增加值为23毫秒。QTc间期的延长与Mobocertinib的剂量正相关。
患者的年龄,体重,种族,性别和轻度至中度肝肾功能不全,对Mobocertinib的药代动力学没有临床意义上的影响。
Mobocertinib通过肝CYP3A代谢,中效或强效CYP3A抑制剂将会增加血药浓度,比如连续同服强效CYP3A抑制剂伊曲康唑或酮康唑时,Mobocertinib和其活性代谢产物的浓度-时间曲线下的面积(AUC)增加374-419%。印度博生药房商城收集整理indbsa.com连续同服中效CYP3A抑制剂时,Mobocertinib和其活性代谢产物的AUC增加100-200%。与一种强效CYP3A诱导剂利福平连续同服时,Mobocertinib和其活性代谢产物的AUC降低92%。与一种中效CYP3A诱导剂依法韦伦连续同服时,Mobocertinib和其活性代谢产物的AUC降低58%。
Mobocertinib与咪达唑仑(一种CYP3A底物)联用时,咪达唑仑的AUC降低,口服(32%)或静脉(16%)。
与P-gp底物地高辛或达比加群酯联用时,没有发现对Mobocertinib的药代动力学有临床意义上的影响。
体外研究中,Mobocertinib不抑制CYP1A2, 2B6, 2C8, 2C9, 2C19和2D6。Mobocertinib是P-gp和BCRP抑制剂。Mobocertinib不抑制BSEP, MATE1, MATE2 - K, MRP2, OATP1B1,
OATP1B3, OAT1,OAT3, OCT1和OCT2。Mobocertinib是P-gp的底物,不是BCRP, OATP1B1, 和OATP1B3的底物。
临床疗效
储存
于室温(20℃-25℃)下密闭保存,避免受潮。短期可以允许在15℃-30℃。