公司: Eton Pharmaceuticals,Inc
.批准日期: 2020年9月29日
治疗:肾上腺皮质功能不全
Alkindi Sprinkle(胶囊中的氢化可的松颗粒用于打开)是批准的糖皮质激素氢化可的松的速释儿科配方,可用于治疗婴儿,儿童和青少年的肾上腺皮质功能不全。
制药公司Eton Pharmaceuticals,Inc(纳斯达克股票代码:ETON)今天宣布,美国食品和药物管理局药物管理局(FDA)已批准Alkindi Sprinkle(氢化可的松)口服颗粒剂作为17岁以下儿童肾上腺皮质功能不全(AI)的替代疗法。Alkindi Sprinkle是第一个也是唯一一个获得FDA批准的用于治疗肾上腺皮质功能不全的颗粒状氢化可的松制剂,专门设计用于儿童。
FDA对Alkindi Sprinkle的批准是治疗小儿肾上腺皮质功能不全的患者和护理人员的一项突破。我们很高兴能提供一种经FDA批准的产品,该产品能够降低对儿童患者的氢化可的松剂量和给药量,”伊顿制药首席执行官Sean Brynjelsen说道。“我们期待在未来几个月内向患者提供该产品。”
“多年来,我们从父母那里听到他们在努力为孩子提供正确的剂量方面的努力,” CARES基金会执行董事Dina M. Matos说。“我们很高兴FDA批准Alkindi Sprinkle用于小儿肾上腺皮质功能不全的患者,包括先天性肾上腺皮质增生(一种肾上腺皮质功能不全的患者)。”
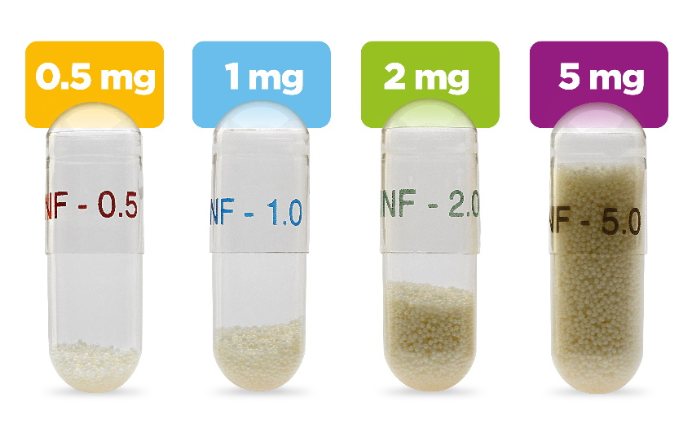
FDA对Alkindi Sprinkle的批准得到了六项临床研究的支持,其中包括首次和唯一的口服氢化可的松对8岁以下儿童小儿AI的介入性III期研究。在Alkindi Sprinkle批准之前,口服氢化可的松仅获得FDA批准的5mg和更强片剂制剂。许多儿科患者需要低得多的剂量和精确滴定的灵活性。Alkindi Sprinkle将以0.5mg,1mg,2mg和5mg的强度提供,使临床医生具有更大的灵活性,可根据每个患者的需要根据剂量和给药说明进行个性化给药。
Eton预计Alkindi Sprinkle将于2020年第四季度上市。
关于小儿肾上腺皮质功能不全
小儿肾上腺皮质功能不全(AI)是一种罕见疾病,其特征在于无法合成和释放皮质醇,有时甚至醛固酮。这会导致雄激素过多(女性的性发育异常,青春期提前,生长提前终止和身材矮小)。小儿AI最常见的形式是先天性肾上腺皮质增生(CAH),它是由遗传缺陷引起的。患有原发性或中枢性(继发性和继发性)AI的患者的系统中缺乏适当水平的皮质醇。系统中的皮质醇减少可能导致致命后果,如肾上腺危机。为了生存,AI患者必须每天更换丢失的皮质醇。伊顿(Eton)估计,在美国,小儿AI会影响5,000至11,000名儿童。
关于阿尔金迪洒
Alkindi Sprinkle是一种速释口服氢化可的松颗粒制剂,专门设计用于满足肾上腺皮质功能不全的小儿患者的剂量需求。在获得Alkindi Sprinkle的批准之前,父母的照顾者必须切割或分割较高强度的氢化可的松片,以达到较小儿童所需的剂量,这可能导致剂量不正确。Alkindi Sprinkle使用经商业验证的技术制造,具有四种强度:0.5mg,1mg,2mg和5mg,为临床医生提供更大的给药灵活性。儿科可接受的掩味赋形剂消除了氢化可的松的苦味。Alkindi Sprinkle在环境温度下的保质期为三年,不需要冷藏。
适应症和用法
Alkindi Sprinkle是一种皮质类固醇激素,可作为肾上腺皮质功能不全的儿科患者的替代疗法。
重要安全信息
禁忌症
Alkindi Sprinkle禁用于对氢化可的松或Alkindi Sprinkle中任何成分过敏的患者。接受糖皮质激素治疗的患者出现过敏反应。
警告和注意事项
肾上腺危机:治疗不足或突然停药可能导致肾上腺皮质功能不全,肾上腺危机和死亡。诸如感染或手术等压力事件也可能诱发肾上腺危机。在压力期间增加剂量。将呕吐,重病或无法口服药物的患者改用肠胃外皮质类固醇制剂。
感染:过量使用可能会增加新感染的风险或任何病原体(包括病毒,细菌,真菌,原生动物或蠕虫感染)潜伏感染的恶化。监视患者的感染迹象和症状。认真对待所有感染,尽早开始服用激素。
生长迟缓:长期过量服用可能导致生长迟缓。使用最小剂量的Alkindi Sprinkle可获得所需的临床反应并监测患者的成长。
由于使用过量的皮质类固醇导致库欣综合征:长时间使用超生理剂量可能会导致库欣综合征。每6个月对患者进行一次库欣综合症的体征和症状监测;一岁以下的儿科患者可能需要更频繁的监测。
骨矿物质密度的降低:皮质类固醇减少骨形成并增加骨吸收,这可能导致抑制骨生长和骨质疏松症的发展。使用最小剂量的Alkindi Sprinkle可获得所需的临床反应。
精神病学不良反应:使用可能与严重的精神病学不良反应有关,例如欣快,躁狂,幻觉,or妄或抑郁症等。症状通常在开始治疗后的几天或几周内出现。减少剂量或停药后,大多数反应会缓解,尽管可能需要特殊治疗。在治疗过程中监视患者的行为和情绪障碍。如果出现精神症状,指导护理人员和/或患者寻求医疗救助。
眼部不良反应:长期使用大剂量已报道白内障,青光眼和中央性浆液性脉络膜视网膜病变。监控患者的视力模糊或其他视觉障碍,如果发生,请将其转诊给眼科医生。
胃肠道不良反应:某些胃肠道疾病患者的风险增加。体征和症状可能被掩盖。
不良反应
皮质类固醇最常见的不良反应包括体液retention留,葡萄糖耐量改变,血压升高,行为和情绪变化,食欲增加和体重增加。
关于伊顿制药
Eton Pharmaceuticals,Inc.是一家专门制药公司,致力于开发和商业化用于罕见儿科疾病的创新疗法。Eton主要专注于医院可注射和小儿罕见病产品。该公司目前拥有或获得FDA批准的三款产品的特许权使用费,包括ALKINDI®SPRINKLE,Biorphen®和Alaway®Preservative Free,并在后期产品线中增加了六种产品,其中四种已提交给FDA。 。
